Thuốc Sorafenib 200mg được đồng phát triển và đồng sản xuất bởi Bayer và Onyx Pharmaceuticals như Nexavar của Ấn Độ.
Là một thuốc ức chế kinase được chấp thuận để điều trị ung thư thận nguyên phát (ung thư tế bào thận tiên tiến), ung thư biểu mô tế bào tiên tiến tiên phát (carcinoma tế bào gan) và ung thư biểu mô tuyến giáp tiên phát kháng iốt phóng xạ.
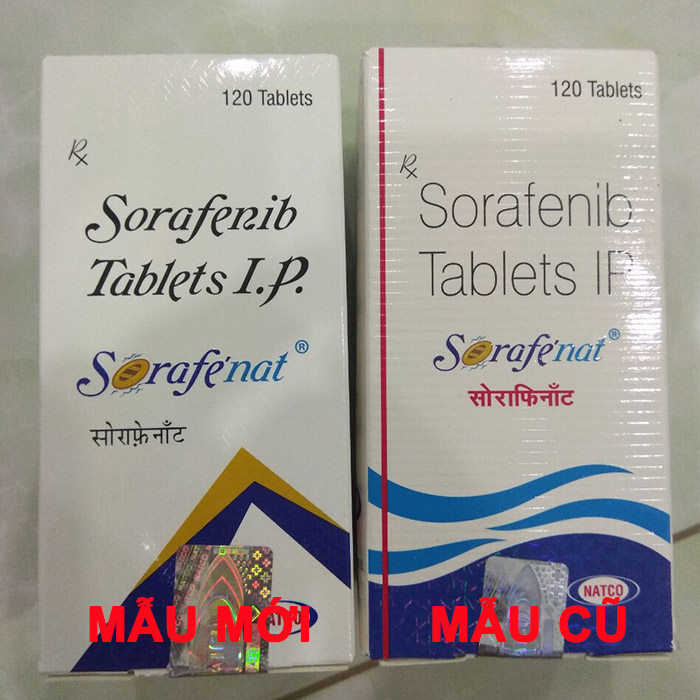
Lưu ý: Bắt đầu từ ngày 07/12/2018 thuốc Sorafenat 200mg có một số thay đổi trên vỏ hộp thuốc. Vì vậy chúng tôi xin được thông báo đến quý bệnh nhân được biết để tiện cho việc sử dụng thuốc. Hình hộp thuốc mới chúng tôi xin phép được cập nhật bên dưới.
1) Cơ chế hoạt động của thuốc Sorafenib 200mg
Sorafenib là một chất ức chế một số kinaza protein tyrosine, chẳng hạn như VEGFR, PDGFR và kinase gia đình Raf (ít hăng hái hơn C-Raf hơn B-Raf), vì vậy Sorafenib có thể ngăn chặn sự phát triển khối u.
2) Chỉ định của thuốc Sorafenib 200mg
Tại thời điểm hiện tại, sorafenib được chỉ định như là một phương pháp điều trị ung thư biểu mô tế bào thận tiên tiến (RCC), ung thư biểu mô tế bào gan (HCC) và ung thư tuyến giáp không hủy được.
Ung thư thận
Kết quả thử nghiệm lâm sàng, xuất bản Tháng 1 năm 2007, cho thấy, so với giả dược, điều trị bằng sorafenib kéo dài sự sống còn không có tiến triển ở những bệnh nhân ung thư biểu mô tế bào thận rõ ràng tiên tiến mà trước đây liệu pháp đã thất bại. Tỷ lệ sống sót trung bình là 5,5 tháng ở nhóm sorafenib và 2,8 tháng ở nhóm dùng giả dược (tỷ số nguy cơ tiến triển bệnh ở nhóm sorafenib, khoảng tin cậy 0,44, 95% CI, 0,35 đến 0,55, P <0,01).
Ung thư gan
Tại ASCO 2007, các kết quả từ nghiên cứu SHARP [13] đã được trình bày, cho thấy hiệu quả của sorafenib trong ung thư tế bào gan. Điểm cuối cùng chính là tỷ lệ sống sót chung trung bình, cho thấy sự cải thiện 44% ở những bệnh nhân dùng sorafenib so với giả dược (tỷ lệ nguy cơ 0,69, 95% CI, 0,55 đến 0,87, p = 0,0001). Cả hai tỷ lệ sống sót trung bình và thời gian để tiến triển cho thấy cải tiến 3 tháng; tuy nhiên, không có sự khác biệt đáng kể về thời gian trung vị đối với tiến triển triệu chứng (p = 0.77). Không có sự khác biệt về chất lượng cuộc sống, có thể là do độc tính của sorafenib hoặc các triệu chứng liên quan đến sự tiến triển cơ bản của bệnh gan. Lưu ý, thử nghiệm này chỉ bao gồm những bệnh nhân bị xơ gan cấp A Child-Pugh (tức là nhẹ nhất). Do thử nghiệm này Sorafenib đã được FDA chấp thuận để điều trị ung thư biểu mô tế bào tiên tiến vào tháng 11 năm 2007.
Trong một thử nghiệm lâm sàng ngẫu nhiên, mù đôi, pha II kết hợp sorafenib với doxorubicin, thời gian trung vị tiến triển không chậm đáng kể so với doxorubicin ở bệnh nhân ung thư biểu mô tế bào tiên tiến. Thời gian trung bình của sự sống sót và sự sống còn không có tiến triển lâu hơn đáng kể ở những bệnh nhân dùng sorafenib và doxorubicin hơn so với những người chỉ dùng doxorubicin.
Một nghiên cứu giai đọan một trung tâm tiền cứu duy nhất bao gồm những bệnh nhân ung thư biểu mô tế bào gan không thể thẩm tách kết luận rằng kết hợp sorafenib và DEB-TACE ở những bệnh nhân HCC không thể điều trị được dung nạp tốt và an toàn với hầu hết các độc tính liên quan đến sorafenib
Ở Úc, đây là chỉ định duy nhất cho việc sorafenib được liệt kê trên PBS và do đó chỉ có chỉ định của chính phủ về sorafenib.
Ung thư tuyến giáp
Vào ngày 22 tháng 11 năm 2013, thuốc sorafenib đã được FDA chấp thuận để điều trị ung thư tuyến giáp tái phát hoặc di căn theo thời gian (DTC) tái phát cục bộ hoặc di căn cục bộ đến điều trị bằng iốt phóng xạ.
Cuộc thử nghiệm QUYẾT ĐỊNH Giai đoạn 3 cho thấy sự cải thiện đáng kể về tỷ lệ sống sót không có tiến triển nhưng không có trong tỷ lệ sống chung. Tuy nhiên, như đã biết, tác dụng phụ rất thường xuyên, đặc biệt là bàn tay và phản ứng trên da chân.
Khối u Desmoid
Một thử nghiệm lâm sàng giai đoạn 3 đang được tiến hành thử nghiệm hiệu quả của Sorafenib 200mg trong điều trị các khối u desmoid (còn được gọi là chứng xơ gan nặng) sau những kết quả dương tính trong hai giai đoạn đầu thử nghiệm đầu tiên. Liều dùng thường là một nửa so với liều dùng cho ung thư ác tính (400 mg so với 800 mg). NCI đang tài trợ thử nghiệm này.
3) Tác dụng phụ của thuốc Sorafenib 200mg
Tác dụng phụ theo tần suất gặp phải.
Rất phổ biến (> 10% tần suất)
Xuất huyết, Tăng huyết áp, Bệnh tiêu chảy, Phát ban, Rụng tóc (rụng tóc, xảy ra ở khoảng 30% bệnh nhân nhận sorafenib), Hội chứng chân tay, Ngứa (ngứa), Đau thắt ngực, Tăng amylase,
Tăng lipase, Mệt mỏi
Thường gặp (tần số 1-10%)
Giảm bạch cầu, Thiếu máu, Giảm tiểu cầu, Biếng ăn (giảm cân), Hạ kali máu, Phiền muộn, Bệnh lý thần kinh cảm giác ngoại vi, Ù tai Suy tim sung huyết, Nhồi máu cơ tim, Thiếu máu cơ tim, Khàn tiếng, Táo bón, Viêm miệng, Chứng khó tiêu, Chứng nhồi máu, Da khô, Viêm da tróc da, Mụn trứng cá,Sâu rang, Chứng đau thắt lung, Đau cơ, Suy thận, Protein niệu, Rối loạn chức năng dạ con, Suy nhược (yếu), Sốt, Bệnh giống như cúm, Sự gia tăng transaminase, Không phổ biến (tần số 0.1-1%), Bệnh thận nang, Nhiễm trùng, Phản ứng quá mẫn, Hypothyroidism, Chứng tăng tuyến giáp, Hạ huyết áp, Mất nước, Bệnh thiếu máu não hậu sau có thể hồi phục, Cuộc khủng hoảng tăng huyết áp, Rong chân miệng, Các sự kiện giống như phổi kẽ trong, Bệnh trào ngược dạ dày thực quản (GORD), Viêm tụy
Viêm dạ dày, Các lỗ thủng đường tiêu hóa, Tăng bilirubin dẫn đến chứng vàng da, Viêm túi mật, Viêm màng não, Chàm, Nốt đỏ đa, Keratoacanthoma, Ung thư biểu mô tế bào vảy, Gynaecomastia (sưng vú ở nam giới), Sự gia tăng thoáng qua phosphatase kiềm trong máu, INR bất thường, Mức Prothrombin bất thường, phản ứng da củ cải
Khá hiếm (tần số từ 0,01-0,1%)
QT kéo dài khoảng cách, Phù chi, Phản ứng phản vệ, Viêm Gan, Bức xạ gọi là viêm da
Hội chứng Stevens-Johnson, Chứng vasculitis túi thừa, Hoại tử biểu bì độc hại, Hội chứng thận hư, Rạn nứt da,
4) Lịch sử các chỉ định của Sorafenat được công nhận
Ung thư thận
Sorafenib đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt vào tháng 12 năm 2005 và đã được uỷ quyền tiếp thị của Ủy ban Châu Âu vào tháng 7 năm 2006 để sử dụng trong điều trị ung thư thận tiến triển.
Ung thư gan
Ủy ban châu Âu đã cho phép thuốc tiếp thị cho thuốc để điều trị các bệnh nhân ung thư biểu mô tế bào gan (HCC), dạng ung thư gan phổ biến nhất vào tháng 10 năm 2007 và đã được FDA chấp thuận cho chỉ định này vào tháng 11 năm 2007.
Vào tháng 11 năm 2009, Viện Quốc gia về Chất lượng Tuyệt vời của Vương quốc Anh đã từ chối phê duyệt loại thuốc này để sử dụng trong NHS ở Anh, xứ Wales và Bắc Ailen, cho biết hiệu quả của nó (tăng tỷ lệ sống sót trong ung thư gan nguyên phát lên 6 tháng) không chứng minh được mức giá cao , lên đến £ 3000 mỗi bệnh nhân mỗi tháng. [25] Tại Scotland, loại thuốc này đã bị ủy quyền bởi Hiệp hội Dược phẩm Scottish để sử dụng trong NHS Scotland, vì cùng một lý do.
Tháng 3 năm 2012, Cơ quan Sáng chế Ấn Độ đã cấp một công ty trong nước, Natco Pharma, một giấy phép sản xuất Sorafenib chung, làm giảm giá của nó xuống 97%. Bayer bán hàng tháng, 120 viên, của Nexavar cho ₹ 280.000 (4.300 USD). Natco Pharma sẽ bán 120 viên cho ₹ 8.800 (130 đô la Mỹ), trong khi vẫn phải trả 6% tiền bản quyền cho Bayer. Tiền bản quyền của Bayer sau đó đã được Bayer nâng lên 7%. [26] [27] [28] Theo Đạo luật Sáng chế của Ấn Độ năm 2005 và Hiệp định TRIPS của Tổ chức Thương mại Thế giới, chính phủ có thể ban hành giấy phép bắt buộc khi một loại thuốc không có sẵn ở một mức giá phải chăng.
Ung thư tuyến giáp
Vào ngày 22 tháng 11 năm 2013, sorafenib đã được FDA chấp thuận để điều trị ung thư tuyến giáp tái phát hoặc di căn theo thời gian (DTC) tái phát cục bộ hoặc di căn cục bộ đến điều trị bằng iốt phóng xạ.
5) Thuốc Sorafenib 200mg giá bao nhiêu?
Hiện thuốc sorafenib 200mg hay còn gọi là thuốc sorafenat 200mg được bán công khai trên hệ thống website của chúng tôi với giá thuốc Sorafenat là 4.000.000/ hộp 30 viên.
Khách hàng có nhu cầu mua số lượng lớn/mua sỉ vui lòng liên hệ qua số điện thoại 0941.815.813 để được có giá tốt nhất.
6) Thuốc Sorafenib 200mg mua ở đâu?
Tại Việt Nam, quý khách có thể mua tại